La conductividad eléctrica de las sustancias consiste en un desplazamiento de la carga eléctrica a través de ellas. Dicho movimiento de las cargas puede producirse de dos maneras distintas:
- A través de un flujo de electrones, como sucede en los metales, a los cuales se les conoce como conductores de primera especie.
- A través del movimiento de los iones positivos y negativos, mediante una disolución o mediante un compuesto iónico fluido. Esta forma de conductividad se conoce como conductividad iónica, también llamada, electrolítica, tratándose de la conductividad propia de los electrolitos que son conductores de segunda especie.
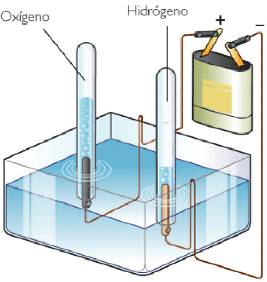
La conductividad eléctrica se lleva a cabo en cubas o celdas electrolíticas, para poder reproducir una reacción de oxidación- reducción, en la electrólisis, proceso que tiene gran interés práctico.
Una cuba electrolítica es un recipiente en el cual se lleva a cabo el proceso de la electrólisis. Dicho recipiente contiene una disolución en la que se sumergen los electrodos, ambos conectados a una fuente de corriente continua, gracias a la cual la cuba recibe electrones.
Los electrodos son las superficies sobre las que tienen lugar las semirreacciones redox.
Generalmente son de carácter inerte con respecto a los reactivos que se encuentran en la cuba electrolítica. En los electrodos podemos distinguir un cátodo, y un ánodo, al igual que ocurre en las pilas voltaicas.
- Ánodo: electrodo en el cual se produce la oxidación, éste va conectado al polo positivo de la fuente de corriente.
- Cátodo: electrodo donde se produce la reducción, éste se conecta al polo negativo de la fuente de corriente.
- En una pila voltaica, la reacción química produce energía eléctrica, en cambio en la cuba electrolítica es justo al contrario, la energía eléctrica produce una reacción química.
- En las pilas, hay dos electrolitos, y en las cubas electrolíticas solamente uno.
- Las reacciones redox son espontáneas en las pilas voltaicas, mientras que en las cubas electrolíticas, no lo es.
- En las pilas, el ánodo es el polo negativo, y el cátodo el positivo, viceversa en las cubas electrolíticas.
- Oxidación en el ánodo: 2 H2O (l) – 4 e^- → O2 (g) + 4H^+ (aq)
- Reducción en el cátodo: 4H^+ (aq) + 4e^- → 2 H2 (g)
- Reacción global: 2H2O (l) → 2H2 (g) + O2 (g)
Los aniones sulfato del ácido se oxidan después que el agua, éstos necesitan un potencial elevado para descargarse, así que no lo hacen. El ácido sulfúrico no es consumido.
LAS REGLAS INVOLUCRADAS EN UIQPA Y ESCRITURA DE LAS FÓRMULAS.
Las reglas de la UIQPA para nombrar un alcano complejo o ramificado son las siguientes.
1.El nombre genérico corresponde al hidrocarburo o a la respectiva función.
2.Se elige la cadena continua más larga de átomos de carbono, aunque se presente en línea quebrada. Esta cadena determina el nombre base del compuesto.
3.Cada ramificación de la cadena principal se considera como u sustituyente que se deriva de otro hidrocarburo, para este sustituyente se cambia el sufijo ano por il.
4.Se enumeran los carbonos de la cadena base continua, de modo que los sustituyentes queden ubicados en los números más bajos.
5.Cada sustituyente recibe un nombre y un número. Para grupos sustituyentes iguales se utilizan los prefijos di, tri, tetra, etc., y se repiten los números en la escritura.
6.Los números se separan entre sí por comas y las letras por guiones.
7.El nombre de los grupos sustituyentes se escribe en orden de complejidad, o sea, de acuerdo al número de carbonos, así: metil, etil, propil, butil, etc. y antes del nombre base del compuesto.
Nota.
En la actualidad es correcto también nombrar los radicales alquílicos en orden alfabético.
8.En compuestos donde uno de los sustituyentes sea un derivado halogenado, éste se escribe en primer lugar. Si hay más de uno, se escribe en orden alfabético, indicando la posición con números la posición. Ejemplo: Bromo, Cloro, Yodo.
9.Cuando hay dos cadenas de igual longitud que puedan seleccionarse como principales, se escoge la que tenga mayor número de sustituyentes.
10.Cuando la primera ramificación se encuentra a igual distancia de cualquier extremo de la cadena más larga, se escoge la numeración que dé el número más bajo a los radicales y cuya suma sea la menor.
11.Cuando sean hidrocarburos insaturados, se determina la cadena que presente el mayor número de carbonos, pero en ella deben quedar incluidos el doble y el triple enlace.
12.Los carbonos en este caso se enumeran empezando por el extremo más cercano al enlace múltiple y se indica su posición anteponiendo al nombre, el número en el cual se encuentra el enlace.
13.Si es un hidrocarburo alicíclico se antepone el prefijo ciclo al nombre del hidrocarburo normal de igual número de carbonos. Si hay ramificaciones, el anillo se enumera de tal manera que la posición de ellas quede indicada por los números más pequeños.
14.En los compuestos que contienen varios grupos funcionales se sigue el orden de prioridad estudiado y para nombrar los grupos funcionales secundarios.
2.Se elige la cadena continua más larga de átomos de carbono, aunque se presente en línea quebrada. Esta cadena determina el nombre base del compuesto.
3.Cada ramificación de la cadena principal se considera como u sustituyente que se deriva de otro hidrocarburo, para este sustituyente se cambia el sufijo ano por il.
4.Se enumeran los carbonos de la cadena base continua, de modo que los sustituyentes queden ubicados en los números más bajos.
5.Cada sustituyente recibe un nombre y un número. Para grupos sustituyentes iguales se utilizan los prefijos di, tri, tetra, etc., y se repiten los números en la escritura.
6.Los números se separan entre sí por comas y las letras por guiones.
7.El nombre de los grupos sustituyentes se escribe en orden de complejidad, o sea, de acuerdo al número de carbonos, así: metil, etil, propil, butil, etc. y antes del nombre base del compuesto.
Nota.
En la actualidad es correcto también nombrar los radicales alquílicos en orden alfabético.
8.En compuestos donde uno de los sustituyentes sea un derivado halogenado, éste se escribe en primer lugar. Si hay más de uno, se escribe en orden alfabético, indicando la posición con números la posición. Ejemplo: Bromo, Cloro, Yodo.
9.Cuando hay dos cadenas de igual longitud que puedan seleccionarse como principales, se escoge la que tenga mayor número de sustituyentes.
10.Cuando la primera ramificación se encuentra a igual distancia de cualquier extremo de la cadena más larga, se escoge la numeración que dé el número más bajo a los radicales y cuya suma sea la menor.
11.Cuando sean hidrocarburos insaturados, se determina la cadena que presente el mayor número de carbonos, pero en ella deben quedar incluidos el doble y el triple enlace.
12.Los carbonos en este caso se enumeran empezando por el extremo más cercano al enlace múltiple y se indica su posición anteponiendo al nombre, el número en el cual se encuentra el enlace.
13.Si es un hidrocarburo alicíclico se antepone el prefijo ciclo al nombre del hidrocarburo normal de igual número de carbonos. Si hay ramificaciones, el anillo se enumera de tal manera que la posición de ellas quede indicada por los números más pequeños.
14.En los compuestos que contienen varios grupos funcionales se sigue el orden de prioridad estudiado y para nombrar los grupos funcionales secundarios.
TIPOS DE FERTILIZANTES:
Los fertilizantes pueden clasificarse de distinta maneras, ya sea según su origen ( inorgánicos e orgánicos ), composición (puros y compuestos) o característica (líquidos y sólidos) y usos a los que están destinados.
Fertilizantes Inorgánicos
Fertilizantes Inorgánico:
Pueden ser de origen natural extraídos de la tierra, como el nitrato (de Chile) o bien sintéticos elaborados por el hombre.
Las plantas no distinguen entre procedencia natural o sintética, y ambos se descomponen antes de ser absorbidos.
Generalmente los de este tipo son de acción rápida y estimulan el crecimiento y vigor de las plantas cuando se aplican sobre la superficie.
MÉTODOS DE OBTENCIÓN DE SALES.
Metal + No Metal ---> Sal.
Al calentar la mezcla se produce una transformación de las sustancias que la forman, se puede apreciar la formación de un sólido de color negro, es decir, se ha formado una nueva sustancia llamada sulfuro de hierro (II), lo que evidencia la ocurrencia de una reacción química en la que se desprende energía en forma de calor, por lo que se clasifica como una reacción química exotérmica.
Se puede observar mediante esta ecuación química, que se han puesto en contacto dos sustancias simples: una metálica (hierro) y una no metálica (octazufre) y al suministrar calor al sistema se ha formado una nueva sustancia, en este caso una sal binaria.
S8(S) + 8Fe(S)---> 8FeS(s)
Ecuación química que representa la reacción de obtención en la sal binaria Sulfuro de Hierro II.
BIBLIOGRAFÍA:
__________________________________
Antonio Rico Galicia
Rosaelva Perez Orta
Dirección general del plantel.



No hay comentarios:
Publicar un comentario